Atom je definován jako nejmenší částice každé hmoty a běžným způsobem již dále nedělitelný. Má své jádro a obal, které obsahují nabité částice. V jádře je možné nalézt protony a neutrony, v obalu elektrony. Na vlastnostech atomu závisí rysy daného prvku.
Ke vzniku hmoty je třeba spojení několika atomů, z nichž vznikají molekuly a ty pak tvoří prvky. Atomy však vedle sebe nemohou být jen tak – potřebují být k sobě nějakým způsobem připoutány. K tomu slouží tzv. atomové vazby. Je jich několik druhů, ale ty nejdůležitější jsou tři hlavní:

Kovová vazba
Tato vazba existuje v kovových materiálech. Elektrony jsou mezi sebou vázány slabě a je dokonce možný pohyb některých, úplně volných, v dané hmotě, a to bez poškození struktury. Fungují zde přitažlivé síly mezi jádry atomů a jejich obalem. Kovy mají proto obvykle nízkou tvrdost a pevnost, jsou plastické a tepelně i elektricky vodivé.
Kovalentní vazba
Tato vazba je nejsilnější ze všech a je založena na vzájemném sdílení volných elektronů mezi atomy jednoho i více prvků a jejich počet závisí právě na počtu volných elektronů. Látky s těmito vazbami bývají velmi stabilní a nerozpustné, mají vysoký bod tání a jsou elektricky i tepelně nevodivé.
Iontová vazba
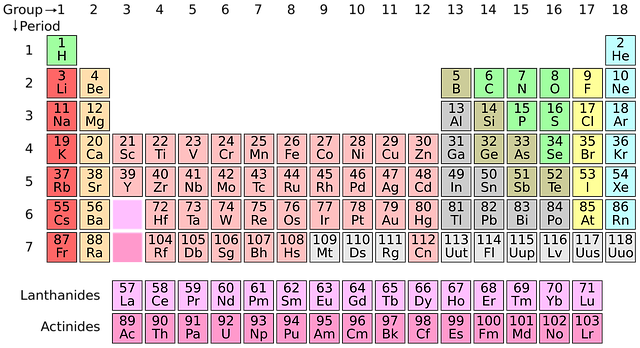
Ionty jsou nabité částice a mohou být kladné a záporné. Jistě už jste viděli takovou barevnou tabulku zvanou periodická soustava prvků. Prvky z levé části periodické tabulky (zejména ty z první a druhé skupiny) snadno tvoří kladně nabité ionty a jsou označovány jako elektropozitivní. Ty z pravé části rády přijímají elektrony (říká se jim elektronegativní prvky) a tím se stávají záporně nabité. Opačné náboje se, jak známo, přitahují, a tak se kladně a záporně nabité ionty přiblíží a vznikne iontová vazba. Tuto vazbu mívají pevné látky typu solí (třeba chlorid sodný, fluorid vápenatý).
Existují ještě další vazby mezi atomy, ty jsou však podstatné o něco méně. Lze jmenovat například Van der Waalsovy mezimolekulové síly, které jsou nejslabší a lze je nalézt kupříkladu mezi jednotlivými vrstvami grafitu.